|
2020 年,中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室在开展非洲猪瘟流行病学监测及病原学研究中发现,我国部分省区出现了低致死率的非洲猪瘟基因 II 型自然变异流行株。这些变异株至少包括4种CD2v编码失活突变类型,导致病毒粒子失去吸附红细胞型;相比典型强毒致病力降低,但仍具有明显的残留毒力,较高剂量接种猪可引起亚急性、慢性病程和部分死亡,较低剂量感染则主要引起持续感染和慢性病程,具有很强的水平传播能力。这些变异株临床表现具有一定的隐蔽性,早期诊断难度加大,为我国非洲猪 瘟防控带来全新的挑战,必须加以高度重视,尽快制定和采取应对策略。
(相关研究论文 “Emergence and prevalence of naturally occurring lower virulent African swine fever viruses in domestic pigs in China in 2020” 已于 2021 年 2 月 24 日在线预发表在 SCIENCE CHINA Life Sciences。)非洲猪瘟(African Swine fever,ASF)是由非洲猪瘟病毒(African Swine Fever Virus,ASFV)引起的各年龄段家猪与野猪的急性、烈性、高度接触性且高发病率和死亡率的传染病,给养猪业带来严重的经济损失并威胁全球粮食安全。目前 尚无商品化疫苗或有效的治疗方法。ASF 被世界动物卫生组织(OIE)列为应通报疾病,世界粮食及农业组织将其列为主要跨界动物疾病。该病 1914 年首次报道于非洲肯尼亚 ,1957 年从非洲传至葡萄牙,现在主要流行于非洲、东欧和亚洲,给世界范围内生猪产业带来巨大威胁。ASFV 结构复杂,在环境中极其稳定。ASFV 在家猪和野猪中长期流行传播,造成病毒遗传变异多样化。根据 B646L 基因(P72)可变 3'-末端的核苷酸序列,ASFV 已鉴定出至少 24 种基因型。目前,欧洲主要流行基因 I 和 II 型,而亚洲主要流行基因 II 型。
2018 年 8 月,ASF 传入我国并迅速扩散,给我国生猪产业造成了巨大的经济损失,尚无产业化应用的疫苗和药物,早期诊断及感染猪群扑杀是目前防控主要策略。流行病学监测及流行株的基因组变异、生物学表型及致病力研究对非洲猪瘟防控具有关键指导意义。中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室于 2018年首次分离鉴定了我国第一株非洲猪瘟病毒Pig/HLJ/2018 (HLJ/18),动物回归试验证实 HLJ/18 感染家猪表现为急性病程及高度致死。非洲猪瘟已在我国流行了两年多,田间流行毒株的基因组变异及生物学和致病性表 型进化亟待解析。
1、非洲猪瘟病毒监测
2020 年 6 月至 12 月,国家非洲猪瘟专业实验室按照农业农村部畜牧兽医局统一安排,执行《农业农村部畜牧兽医局关于调整部分省份非洲猪瘟监测工作的通知》及《农业农村部畜牧兽医局关于调整规模猪场等场所非洲猪瘟采样检测任务分工的通知》(农牧便函〔2020〕670 号)的要求,对黑龙江、吉林、辽宁、内蒙古以及陕西 5 省进行常态化非洲猪瘟主动监测与流行病学调查,总计采集并检测、分析病原学样品 3522 份;同时,对部分省市送检的138份疑似阳性样品进行了鉴定及检测。所有样本使用 OIE 推荐的 qPCR 方法对病毒 p72 基因进行检测。ASFV DNA 阳性样品利用猪原代肺泡巨噬细胞(PAM)进行病毒分离,最终成功分离到 22 株非洲猪瘟病毒(表 1)。
2、ASFV 分离株的遗传变异分析
为了分析 22 株病毒的遗传变异情况,选取 ASFV 重要的抗原基因、毒力决定基因和高突变区的 23 个 ORF 或区域进行了克隆测序。序列分析表明,所有分离株 B646L 基因(p72 蛋白)序列与 HLJ/18 一致,均属于基因 II 型。23 个 ORF 或区域中的 15 个未产生任何突变。而余下 8 个 ORF 或区域(MGF_110-14L、 MGF_110-1L、EP402R、CP530R、E199L、O174L、TRS 以及 A238L)存在不同程度的核苷酸突变和缺失、片段插入及小片段替换情况(图 1)。

将 22 株 ASFV 分离株的 EP402R 基因(编码 CD2v 蛋白)序列与我国第一株强毒分离株 HLJ/18 基因组序列比较分析发现,有 11 株病毒存在核苷酸突变或 缺失:HLJ/HRB1/20 病毒在其 EP402R 基因的第 43-67 位缺失 25 个核苷酸;9 株病毒(HLJ/JMS3/20、HLJ/JMS5/20、HLJ/JMS9/20、HLJ/JMS11/20、HLJ/BLA3/20、 HLJ/BLA6/20、HuB/1/20、HuB/4/20 以及 HuB/SP1/20)存在 G131A 突变, 此 外,三株湖北分离株还存在 G178A 和 G242A 的突变;HeB/Q3/20 存在 C301T 突 变(图1)。这些突变或缺失导致病毒 CD2v 蛋白翻译提前终止,不能编码出完 整有功能的 CD2v 蛋白。CD2v 是病毒吸附红细胞活性(HAD)所必须的重要蛋 白 ,通过 HAD 试验证实所有 CD2v 蛋白翻译提前终止的突变株均丧失红细胞吸 附能力(表1)。
MGF_110-1L 位于非洲猪瘟病毒基因组高变区,分析发现分离株的 MGF_110-1L 基因呈现一定的多态性(图2)。系统进化树分析显示,17 株病毒 与 HLJ/18 在一个分支,湖北分离的 3 株(HuB/1/20、HuB/4/20 以及 HuB/SP1/20)及 HLJ/HRB1/20和HeB/Q3/20 在另一个分支,而 HLJ/HRB1/20 和 HeB/Q3/20 又 处在该分支的不同位置(图2A)。其中第二个分支五株病毒的 MGF_110-1L 第 654 至 649 位核苷酸序列不同于其他毒株,该片段可能来源于病毒基因组的其他部位,从而发生了小片段的替换。这种替换使五株病毒的 MGF_110-1L 蛋白与其他病毒相比多了 73 个氨基酸(图 2C)。此外,与 HLJ/18 相比,所有分离株在 MGF_110-14L 基因中都有 1-6 个 C 缺失或插入(图1);六株病毒在 CP530R、 O174L 或 E199L 基因具有单点突变(图1);HLJ/BY2/20 和 JL/1/20 病毒在 I173R 和 I329L 基因之间插入了 10 个核苷酸的串联重复序列(TRS)(图1)。

图 1. 2020 年中国 22 株田间分离的 ASFV 存在核苷酸插入、缺失、突变和替换。将 22 株 ASFV 的 8 个 ORF 或相关区域与中国第一株 ASFV 分离株 HLJ/18(Pig/HLJ/2018)相应 序列进行比对。ORF 或区域的名称标注于每部分的上方。
文献证明 A238L基因能抑制 NF-κB 和 NFAT 介导的先天免疫反应,进而逃 避宿主免疫应答。序列分析发现,HLJ/HRB1/20病毒A238L基因的536-549位 发生 14 个核苷酸的缺失,造成其自 179 位氨基酸开始移码,与其它毒株相比增 加了 4 个氨基酸(图1)。对 HLJ/HRB1/20 进行全基因组序列测定(GenBank 登 录号 MW656282),分析发现其基因组上没有明显的人工改造标记,如报告基因或标签等。

图2. MGF_110-1L 基因遗传变异分析。2020 年田间分离的 22 株病毒与 HLJ/18 的 MGF_110-1L 基因系统进化树(A)。利用 Neighbor-joining 方法对 MGF_110-1L 序列进行分 析绘制系统进化树(Bootstrap value=1000)。与 HLJ/18 相比,分离株 MGF_110-1L 基因的核 苷酸差异(B)和氨基酸差异(C)。
3、ASFV 分离株的体外培养特性鉴定
根据分离地点及基因组遗传变异特点,我们选取四株 ASFV(HuB/628/20、 HLJ/44/20、HLJ/HRB1/20 和 HeB/Q3/20)进行体外生物学特性分析。间接免疫 荧光(IFA)结果显示 4 株病毒均可以在 PAM 细胞上进行有效复制(图 3A)。HAD 试验确定 HuB/628/20 和 HLJ/44/20 可以形成典型的 HAD 表型;但 HeB/Q3/20 和 HLJ/HRB1/20 呈现 HAD 表型阴性,不能吸附红细胞(图 3A),与 基因组变异分析结果一致。电镜观察四株病毒之间没有明显的形态学差异(图 3A)。复制动力学显示,四株病毒可以在 PAM 中有效复制,感染后第五天细胞 上清液中的 p72 基因拷贝数均大于108/mL(图3B)。
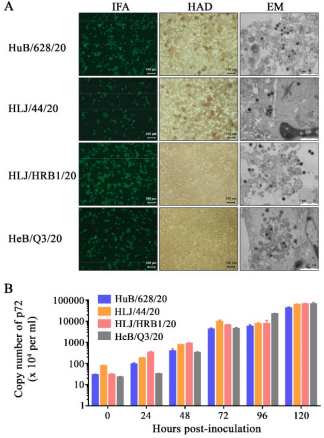
图 3. ASFV 分离株体外生物学特征。(A)将 HuB/628/20,HLJ/44/20,HeB/Q3/20 和 HLJ/HRB1/20 以 MOI 为 0.1 感染 PAM,接种 24 小时后固定细胞,使用间接免疫荧光(IFA) 进行分析;以 MOI 为 0.2 感染 PAM,进行 HAD 测定;通过电子显微镜(EM)进行分离株 形态观察。(B)分离株在 PAM 上生长特征。以 MOI 为 0.1 的病毒剂量感染 PAM,不同时 间点收集细胞上清,利用 qPCR 测定上清液中病毒 p72 基因拷贝数。
4、HAD 表型阳性的分离株接种猪急性发病、高度致死对HAD表型阳性的两株病毒HuB/628/20和HLJ/44/20,进行动物回归试验, 评估其对家猪的致病力。分别以102和103 HAD50 两个剂量肌肉注射接种猪,每剂量4头,每天观察接种猪临床症状和死亡情况。HuB/628/20 感染猪第 3 天起 开始出现发病症状,包括发热、精神沉郁、皮肤发绀或呼吸窘迫;感染后后第 5-8 天全部发病死亡。HLJ/44/20 感染猪第 3 天起出现症状;在接种后第 5-6 天全 部死亡(表2和图4)。结果表明,HuB/628/20 和 HLJ/44/20 对家猪的致病力与 HLJ/18 相当,对家猪都表现高度致死。

5、缺失 HAD 表型(non-HAD)分离株毒力降低,接种猪引起持续感染、慢性 病程和部分死亡已有研究证明 CD2v 是影响非洲猪瘟病毒毒力的重要功能基因之一。人工缺 失 CD2v 编码基因可降低 BA71 株(基因型 I)和 HLJ/18 株(基因型 II)对家猪 致病力,但 CD2v 编码基因缺失不影响 Malawi Lil-20/1 和 Georgia 2010 分离株的 致病力。为了明确 CD2v 编码失活对我国田间毒株致病力的影响,我们选取2株 non-HAD 病毒进行动物回归试验。其中一株为 CD2v 编码区发生25个核苷酸缺 失的黑龙江分离株 HLJ/HRB1/20,另一株为 CD2v 基因 301 位突变的河北分离株 HeB/Q3/20。用106TCID50 和103 TCID50 两个剂量分别接种 SPF 猪,每剂量接种4 头,持续观测 28 天。

图 4. 2020 年 ASFV 分离株对猪致死性分析。为了评估 ASFV 对猪的致病性,将 16 头 无特定病原体(SPF)猪随机分为 4 组,分别以102和103 HAD50 剂量接种 HuB/628/20(A)和 HLJ/44/20(B)毒株;将 16 头 SPF 猪平均分为 4 组,分别以103和106 TCID50剂量接种 HLJ/HRB1/20(C)和 HeB/Q3/20(D)分离株。从接种之日起,将两头 SPF 猪与106 TCID50剂量接种猪同居饲养。每天记录猪的发病和存活情况。
结果发现,HLJ/HRB1/20 分离株106TCID50 接种组有2头猪在接种后的第 10 天出现持续体温升高现象(>40.5℃),第13天共有 3 头猪出现体温升高,另 一头猪在接种后第 22 天出现持续体温升高。103TCID50 接种猪 1 头在接种后第 17 天出现持续体温升高,另一头猪在接种后第 9-12 天持续 4 天高温(表2)。106TCID50 接种4头猪有3头分别在接种后第16 天、23天和24天死亡,有1头猪存活;106TCID50 接种的 4 头猪全部存活(图4)。106TCID50 接种猪普遍出现关 节肿大、腹部和胸部皮肤肿块凸起,腹部脐带处出现皮肤溃烂等亚临床症状(图5)。103TCID50 接种猪也出现了明显的关节肿大现象。对采集的口拭子及肛拭子 进行qPCR病毒核酸检测发现,106TCID50接种猪自接种后第4天开始口腔排毒, 其存活猪排毒一直持续到接种后第 22 天;第10天开始肛门排毒,其存活猪排毒 持续到接种后第 24 天(图6)。103TCID50接种猪在接种后第8天开始出现口腔 排毒,在接种第 24 天后仍有个别猪高水平口腔排毒;在接种后第10天开始肛门 排毒(图6)。接种后不同时间采集抗凝血进行 qPCR 核酸检测,106TCID50接种 猪有 2 头在接种第3天血液中即可检测到低水平病毒核酸拷贝,第 5 天起 4 头猪 血液中全部检测到病毒(图6)。103TCID50接种猪血样检到病毒起始时间较高剂 量组滞后2天,且血液中病毒含量低于高剂量组(图6)。

图5. HLJ/HRB1/20 接种猪的临床症状和组织损伤情况。接种猪表现出关节肿胀(A)、 瘫痪(B)、皮肤肿块(C)和皮肤坏死(D)等临床症状。剖检可见组织损伤变化包括绒毛 心(E)、腹腔积液(F)、关节炎(G)、扁桃体损伤(H)和淋巴结(上颌下淋巴结(I)、腹 股沟淋巴结(J)和纵隔淋巴结(K))充血。
HeB/Q3/20分离株106TCID50接种组有2头猪第8天出现持续体温升高现象, 第 9 天 4 头猪全部体温升高,表现出与 HLJ/HRB1/20 高剂量攻毒组相似的临床 症状(表2);第14天有2 头接种猪发病死亡。103TCID50接种组有2 头猪第8天出现持续体温升高。103TCID50攻毒组的4头猪28天观察期内均存活(图 4);除皮肤坏死外,所有存活猪均表现出与 HLJ/HRB1/20 低剂量攻毒组的猪相似的 病程和临床特征(表2)。2018 年分离的我国第一株非洲猪瘟流行株 HLJ/18,在接种后第 3 天所有猪 就出现体温持续升高,第4天口拭子排毒,第5天肛拭子排毒,10天之内接种 猪全部死亡(Zhao D et al, EMI, 2019)。相比之下,两株 CD2v 功能失活自然变 异株 HLJ/HRB1/20 和 HeB/Q3/20 对 SPF 猪致病力均显著降低。

图 6. HLJ/HRB1/20 接种猪和同居猪采集样品中的病毒载量。在接种后不同时间点采集接种猪和同居猪的口腔拭子、肛拭子及血液样本,通过 qPCR 检测样品中的病毒 p72 基因拷贝数。黑色虚线表示检测下限,1000拷贝/毫升。星号表示由于猪死亡,在指定的时间点无 样品。
6、HLJ/HRB1/20 攻毒猪剖检病变及组织病毒载量对 HLJ/HRB1/20 分离株106TCID50接种组的3头病死猪以及存活至28天试 验猪进行剖检,组织器官病理损伤主要表现为淋巴结充血和肿胀、绒毛心、心包 积液及扁桃体炎症(图5),其中2头猪还出现腹膜炎。HLJ/HRB1/20 103TCID50接种存活猪均出现心包积液(表3)。利用 qPCR 对心脏、肝、脾、肺、肾、扁 桃体和六个淋巴结(肠淋巴结,腹股沟淋巴结,上颌下淋巴结,支气管淋巴结, 胃肝淋巴结和纵隔淋巴结)进行病毒基因组核酸检测,结果显示,在所有病死及 存活猪各组织均检测到病毒核酸,106TCID50攻毒组3只死亡猪的多种组织病毒 载量明显高于存活猪;各种组织中,肺、扁桃体和部分淋巴结中检测到病毒载量 相对更高(图7)。

图7. HLJ/HRB1/20 接种猪与同居猪脏器中的病毒载量。对死亡猪以及接种 28 天后存活猪进 行剖检,采集各种脏器样品进行病毒核酸检测。106TCID50接种组(A)或 103TCID50接种组(B);与 106TCID50接种组同居的猪(C)。利用 qPCR 方法检测病毒 p72 基因拷贝数。黑色虚线表示检测下限。LN1:肠淋巴结;LN2:腹股沟淋巴结;LN3:上颌下淋巴结;LN4:支气管淋巴结;LN5:胃肝淋巴结;LN6:纵隔淋巴结。
7、缺失 HAD 表型(non-HAD)分离株表现出很强接触传播能力为了评估 non-HAD 病毒株接触传播能力,从感染的第一天起,分别将两头 SPF仔猪与106TCID50剂量HLJ/HRB1/20和 HeB/Q3/20接种猪同居饲养,每天观察其临床体征和温度变化,采集血液、口腔拭子以及肛拭子,qPCR检测病毒核酸,评估水平传播能力。
HLJ/HRB1/20 接种组的两头同居猪,分别于第 6 天和第 12 天从口腔拭子中 检测到病毒核酸,第 8 天和第 20 天从肛拭子中检测到病毒核酸(图6);第 21天从一头猪的血样中检测到病毒核酸(图6)。两头同居猪在同居后第28天均未 出现明显的临床症状,同居后第28天进行了安乐死,剖检观察发现部分组织发生轻度病变,包括淋巴结充血、肿大、萎缩与出血点以及肺炎等(表3)。组织器官病毒载量检测发现,一头猪的心脏、脾脏、肺、肾、扁桃体、滑膜、肠道淋巴结、腹股沟淋巴结、上颌下淋巴结、支气管淋巴结、胃肝淋巴结和纵隔淋巴结均检测到病毒核酸;而另一头猪,主要在支气管淋巴结和纵隔淋巴结中检测到病毒核酸(图 7)。

HeB/Q3/20 接种组的2头同居猪有1头猪在第8天从口腔拭子中检测出病毒核酸,第 6 天从肛拭子中检测出病毒核酸;第 17 天在两头猪的血液都检测到 病毒核酸;两头猪所出现的发病病程与症状与103TCID50攻毒组猪相似(表2),其中 1 头同居猪第 24 天发病死亡,另一头28天观察期内存活(图4)。
ASFV 已在我国流行两年有余,但有关流行毒株的进化以及致病性表型研究 鲜有报道。本研究报告了2020年6月至12月在我国部分省份开展的较为系统的 ASFV 流行病监测工作,共分离出22株基因 II 型 ASFV 流行毒株。与最早的分离株 HLJ/18相比,所有2020年分离株基因组序列均发生不同程度的改变,包括核苷酸突变、缺失、插入或短片段替换等。其中 11 株病毒的 EP402R 基因呈现四种不同类型的核苷酸自然突变或缺失,造成这些 CD2v 蛋白编码缺陷,失去 HAD 表型。选取 4 株代表性病毒进行了动物回归试验,发现具有HAD表型的2 株病毒致病力与 HLJ/18 相当,表现为典型高致死性;而2株缺失HAD表型分离株显示出较低的毒力,但依然表现出明显的毒力残留,高剂量感染能引起亚急性和慢性病程,并部分致死感染猪只;低剂量接种主要引起非致死性的持续感染, 以及亚急性或慢性病程。两株病毒均具有很强的水平传播能力,尤其 HeB/Q3/20 表现更为突出。
当前尚无批准疫苗用于 ASF 的防控。ASF 防控主要依靠对感染动物的快速 诊断和及时清除。本研究发现,田间至少存在4种以上的 non-HAD 低致死率基因 II 型自然变异株,虽然致病力较典型强毒株明显降低,但仍然呈现明显的残 留毒力,且具有很强的水平传播能力,很可能已在田间猪群中广泛传播,造成持续的感染、慢性病程甚至死亡,给非洲猪瘟早期诊断带来巨大的障碍,为我国非洲猪瘟防控带来全新的挑战,必须加以高度重视,制定和采取应对策略。
中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室孙恩成副研究 员、张振江博士、王子龙博士、何希君研究员为论文共同第一作者,步志高研究 员和赵东明研究员为共同通讯作者。该研究得到国家重点研发项目 (2018YFC1200601)等项目资助。
原文链接:https://engine.scichina.com/publisher/scp/journal/SCLS/doi/10.1007/s11427-021- 1904-4?slug=abstract
|
